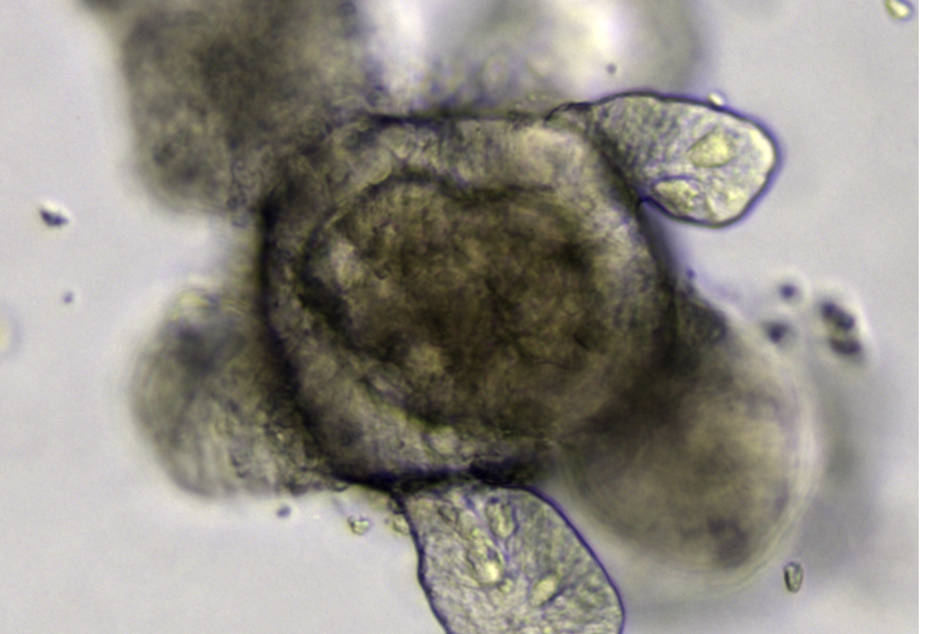
La mise au point de substituts d’organes qui pourraient jouer le rôle de « compagnons biologiques » suscite actuellement un intérêt grandissant. Lancés il y a une dizaine d’années, les premiers développements dans ce domaine ont porté sur la mise au point de puces microfluidiques visant à mimer une fonction biologique particulière d’un tissu, comme la fonction de barrière entre les alvéoles pulmonaires et les capillaires sanguins. Depuis, le nombre de publications scientifiques sur cette thématique s’est considérablement accru, conduisant à la description de deux grands types de familles de compagnons biologiques : les organes sur puce et les organoïdes.
Organes sur puce et organoïdes
Un organe sur puce est un système miniaturisé qui est conçu en s’inspirant de l’architecture d’un organe humain pour mimer ses fonctions physiologiques. Le recours aux microtechnologies permet de perfuser les structures cellulaires (microfluidique) et de contrôler l’environnement physique et biochimique des cellules afin d’obtenir l’architecture multicellulaire souhaitée.
Les organoïdes correspondent, eux, à des « mini organes » ou des « mini tumeurs », obtenus à partir de cellules souches ou progénitrices, mises en culture 3D dans un hydrogel qui mime la matrice extracellulaire. Des co-cultures de différents types cellulaires sont généralement utilisées. Le concept est de laisser les cellules s’auto-organiser en tissu fonctionnel, en jouant principalement sur les suppléments apportés au milieu de culture.

Les compagnons biologiques seront d’autant plus pertinents si nous sommes capables de les vasculariser de manière à être le plus proche possible de la situation qu’on trouve chez l’homme. Cette vascularisation sera apportée ou guidée par la technologie dans le cas des organes sur puce alors qu’elle se fera de manière spontanée pour les organoïdes. Relever ce défi nous rapprochera de la réponse physiologique de l’organe, ce qui légitimera l’utilisation de ces dispositifs pour la mise au point de médicaments, pour l’aide au choix thérapeutique ou pour envisager la médecine régénérative de demain.
En termes d’applications, au moins quatre domaines majeurs peuvent aujourd’hui être identifiés :
L’étude de mécanismes fondamentaux et de processus physiopathologiques. La caractérisation de tous les paramètres d’un compagnon biologique permettra de découvrir les molécules et mécanismes essentiels à maîtriser afin de se rapprocher des fonctions physiologiques normales de l’organe mimé. L’étude de l’altération de ces fonctions, quelle qu’en soit l’origine (cellules mutées, infection, molécule médicamenteuse), complétera nos connaissances sur les processus physiopathologiques qui peuvent toucher l’organe ;
Le support de cribles pharmacologiques. Les compagnons biologiques permettront de rechercher des candidats médicaments capables de corriger un dysfonctionnement. Ils pourront également aider à mieux comprendre le mécanisme d’action d’une molécule pharmacologique, ce qui est nécessaire à la mise sur le marché de tout nouveau médicament ;
L’aide aux choix thérapeutiques personnalisés. En oncologie, les cellules issues de la biopsie de la tumeur d’un patient seront utilisées pour fabriquer un compagnon biologique. Celui-ci permettra alors de tester les molécules les plus efficaces pour traiter la tumeur. On entrera ici dans le domaine de la médecine personnalisée ;
La médecine régénérative. Bien qu’il s’agisse de perspectives plus lointaines, la fabrication maîtrisée et reproductible d’unités fonctionnelles de substituts d’organes constituera une avancée significative pour la médecine régénérative dont la finalité est de remplacer ou réparer un organe défaillant.
Modèles numériques des pathologies
Par ailleurs, les compagnons biologiques contribueront à la révolution numérique à l’œuvre dans le domaine de la santé. Le traitement des données massives issues des approches « omiques » et d’un monitoring quasi continu de constantes physiologiques ou de paramètres biochimiques mesurés sur le patient permettra, en effet, de mettre au point des modèles numériques généraux des pathologies humaines. En parallèle, le vieillissement de la population et la multiplicité des pathologies qui lui sont associée rendront ces modèles toujours plus complexes à créer et à qualifier. Cette évolution va de pair avec le besoin crucial d’adaptation aux cas individuels. À titre d’illustration, c’est la capacité d’adapter en temps réel un modèle numérique général à un patient donné qui fait le succès du dispositif « Diabeloop » pour le traitement des patients diabétiques.
Toutefois, l’impact de l’approche numérique de la santé sera limité si les modèles générés ne peuvent pas être testés. Nul doute que, dans les années à venir, les progrès en ingénierie cellulaire et microtechnologies permettront de produire des compagnons biologiques de plus en plus « fidèles » aux organes mimés. Les analyses réalisées sur ces compagnons biologiques génèreront ainsi des données dont la pertinence s’améliorera sans cesse, permettant d’optimiser les modèles numériques qui guideront les soins prodigués aux patients.
Cet article est publié en partenariat avec le CEA dans le cadre de la nouvelle formule du magazine Clefs dont l’actuel numéro est consacré à la médecine du futur.