C’est dans des laboratoires que nous vaincrons la pandémie actuelle, et peut-être, plus important encore, la prochaine pandémie, grâce à la science fondamentale qui guidera les solutions médicales et les politiques publiques.
Partout sur la planète, la communauté scientifique est mobilisée pour combattre le virus : les chercheurs élaborent des moyens de réutiliser les équipements de protection individuelle, conçoivent des traitements pour les personnes infectées, travaillent à la mise au point de vaccins et tentent de comprendre ce qui rend ce virus si dangereux.
Un des principaux problèmes de la lutte contre la Covid-19 est que nous ignorons pourquoi le SRAS-CoV-2 — le coronavirus responsable de la maladie — est si redoutable. Nous savons que sa létalité est le résultat de petites modifications génétiques, appelées mutations, qui le distinguent des autres virus. Mais de quelles mutations s’agit-il ?
Le SRAS-CoV-2 est un proche parent du SRAS-CoV, le virus qui a causé l’épidémie de SRAS en 2003, mais même entre ces virus étroitement liés, il existe environ 6000 différences génétiques (soit un gros 20 % du génome). Entre ces deux virus et d’autres coronavirus beaucoup moins mortels, le nombre de mutations est encore plus élevé.
Variations mortelles
Laquelle de ces mutations, ou combinaisons de mutations, rend-elle le SRAS-CoV-2 si dangereux ? Ce virus possède 14 gènes qui codent pour 27 protéines. Les protéines sont des chaînes d’acides aminés, et les 6000 différences génétiques entraînent 380 modifications d’acides aminés. Ce sont ces changements et la façon dont ils transforment le fonctionnement des protéines qui confèrent à chaque virus son caractère distinct.
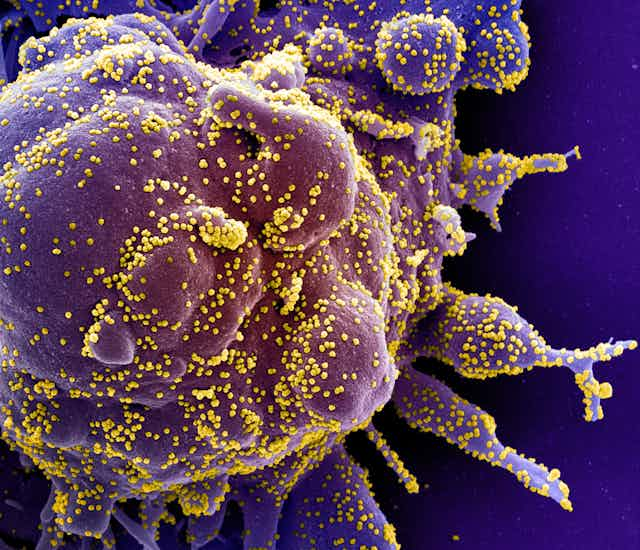
Comme tous les coronavirus, le SRAS-CoV-2 est une boule entourée de pointes. Sur les images obtenues au microscope électronique, ces pointes forment une couronne — la corona qui donne son nom aux virus. Pour infecter un hôte, les pointes se lient à des cellules humaines et contrôlent les gènes du virus qui entrent dans les cellules. Différents coronavirus se fixent à différents récepteurs à la surface des cellules. Le SRAS-CoV-2 et le SRAS-CoV, par exemple, se lient à des récepteurs différents de ceux du virus MERS, ce qui entraîne des pathologies différentes.

Chaque coronavirus possède des pointes d’une forme particulière, et le fait qu’il y ait autant de variations constitue à la fois un défi et une éventuelle solution pour la création d’un vaccin contre le SRAS-CoV-2. Les vaccins fonctionnent en entraînant le système immunitaire à reconnaître un antigène, un aspect précis d’un envahisseur.
Un des défis de la conception d’un vaccin contre le SRAS-CoV-2, ou de tout vaccin, est que la surface varie tellement d’un virus à l’autre que les antigènes changent et qu’un vaccin contre un virus ne saura reconnaître un autre virus. Cependant, si l’on identifie quelque chose qui se trouve sur la surface d’un virus, on pourra éventuellement créer un vaccin contre cet antigène particulier. Dans le cas du SRAS-CoV-2, ses pointes constituent un candidat possible, et des travaux pour les caractériser sont en cours.
Une science délicate
Pourquoi ces pointes ont-elles chacune leur biologie ? Les pointes sont des protéines. Leur forme et leur façon de se fixer dépendent des modifications d’acides aminés. Nous ignorons quelles modifications sont concernées parce que nous ne savons pas comment les changements d’acides aminés affectent la forme et la fonction des protéines. C’est là qu’intervient la science fondamentale.
Mon groupe de recherche étudie comment les substitutions d’acides aminés modifient la fonction et la biologie des protéines, ce qui correspond exactement à ce que nous ne savons pas des mutations du SRAS-CoV-2. Nous travaillons sur une protéine appelée enzyme malique qui convertit le malate, un composé chimique, en pyruvate dans pratiquement tous les organismes vivants. Nous observons ce procédé chez la Drosophila melanogaster, ou mouche à fruits.

Comme toute protéine, l’enzyme malique de la mouche à fruits est une chaîne d’acides aminés repliée sur elle-même pour constituer une structure tridimensionnelle. Imaginez une boule d’élastiques qui ne serait formée que d’un seul très long élastique et qui ne serait pas forcément ronde. Ce dernier aspect est important, car la forme d’une protéine dépend des acides aminés qui composent la chaîne, elle est déterminée par la façon dont s’assemble sa séquence d’acides aminés. Si on change un acide aminé, la forme n’est plus la même, et les protéines ne fonctionnent plus de la même façon. Cet enchaînement — les acides aminés déterminent la forme, la forme détermine la fonction — est aussi valable pour une enzyme métabolique que pour une protéine de pointe virale.
L’enzyme malique de la drosophile est composée de près de 600 acides aminés, mais dans toute l’espèce, seuls deux d’entre eux peuvent différer. Les deux acides aminés qui se trouvent sur le premier site, l’alanine ou la glycine, sont assez semblables, mais leur substitution modifie de près de 30 % l’activité de l’enzyme, ce qui est considérable sur le plan biologique. Un examen approfondi de ce site peut expliquer ce changement. Il se trouve à l’extrémité du site actif de la protéine, la poche dans laquelle l’enzyme décompose le malate, et fait partie d’une hélice, un tourbillon d’acides aminés qui forment une structure ressemblant à un escalier en spirale. Les alanines forment des spirales, mais pas les glycines. Cette modification de près de 30 % de l’activité semble résulter du fait que la spirale est légèrement plus courte ou plus longue, ce qui constitue un changement subtil de la forme, mais une grande différence sur le plan biochimique.
Pour le deuxième site, c’est une tout autre histoire. À cet endroit, les deux acides aminés, la leucine ou la méthionine, sont également assez semblables, mais là encore, nous constatons une différence de l’activité biochimique. Il s’agit d’une différence d’environ 40 % dans la force de la liaison entre l’enzyme et le malate. Le deuxième site n’est pas particulièrement près d’une structure connue, mais se trouve dans une région de la protéine où les acides aminés s’organisent en feuille, interagissant de façon à former une structure semblable à une jupe plissée. La différence subtile entre la leucine et la méthionine modifie probablement la forme de cette feuille, ce qui transforme la biochimie de la liaison.
La compréhension de ces deux petites différences nous aide à cerner comment les variations d’acides aminés entraînent des changements dans la fonction des protéines et à prévoir comment des transformations dans d’autres protéines, p. ex. une pointe virale, peuvent en modifier la fonction.
Compréhension de base
La science fondamentale est à la base d’une grande partie des travaux d’élaboration d’un vaccin contre le SRAS-CoV-2. Les recherches menées dans les laboratoires du monde entier nous permettront de vaincre plus facilement une prochaine pandémie. Notre travail sur les mouches n’est qu’une petite partie de ce processus. Plus nous comprenons les variations des protéines, plus nous serons en mesure de concevoir de nouveaux vaccins et, éventuellement, de prédire quels virus pourraient être mortels.
La pandémie de Covid-19 ne sera probablement pas la seule crise de ce type que nous connaîtrons. Il existe des millions de virus qui pourraient constituer une menace pour l’humain, sans parler des autres agents pathogènes non viraux. Le succès de la lutte contre ces menaces nécessite un solide programme scientifique et un financement important de la recherche fondamentale sur les moyens nouveaux et traditionnels de combattre les maladies infectieuses.