La bilharziose est la deuxième maladie parasitaire humaine la plus importante après le paludisme. Au niveau mondial, plus de 250 millions de personnes ont besoin d’un traitement préventif régulier, ce qui équivaut aux populations de la France, de l’Allemagne, de l’Espagne et de l’Italie réunies.
Pourtant, il y a fort à parier qu’un grand nombre des lecteurs de ces lignes n’ont jamais entendu parler de cette maladie. En effet, la bilharziose a longtemps été considérée comme un problème des pays du Sud : elle n’était endémique – autrement dit, à transmission locale – qu’en Afrique subsaharienne, ainsi qu’au Brésil, où elle a été importée par le commerce des esclaves, et en Asie du Sud-Est.
Mais depuis 2014, la maladie est aussi devenue un problème européen : notre laboratoire a découvert que la bilharziose est désormais également présente dans le sud-est de la Corse, où plusieurs cas sont désormais recensés chaque année.
Selon toute vraisemblance, si vous l’attrapez, vous n’en mourrez pas. Mais cette maladie parasitaire entravera votre bien-être et votre capacité à travailler et à prendre soin de votre famille. Mieux vaut donc s’en préserver.
Il existe bien un médicament capable de lutter contre la maladie, mais il n’empêche pas les réinfections. Et malgré des décennies de recherche, aucune autre molécule ni vaccin n’ont pu être mis au point. La génétique pourrait toutefois fournir de nouvelles armes pour lutter contre ce parasite très invalidant.
Une maladie due à un ver
La bilharziose est causée par de petits vers d’environ 1 cm de long qui siègent dans les veines proches de l’intestin ou de la vessie. On les appelle les schistosomes, ou « corps fendu » en grec ancien. En effet, la femelle vit enchâssée à l’intérieur du mâle comme une saucisse dans un pain de hot-dog, ce qui donne l’impression d’un seul corps scindé en deux.
La bilharziose est transmise par des escargots d’eau douce porteurs du parasite. Ceux-ci constituent les hôtes intermédiaires, tandis que l’hôte final est un mammifère (rongeurs, bétail, être humain…).
C’est dans l’organisme de ces petits escargots aquatiques, appartenant aux genres Biomphalaria ou Bulinus, que se multiplient les larves de schistosomes qui infecteront ensuite les mammifères passant à leur portée, dont l’être humain. Une fois que les larves sortent du corps des mollusques et se disséminent dans l’environnement aquatique, elles disposent d’environ 4 heures pour trouver un hôte final en train de nager ou de marcher dans l’eau, faute de quoi elles mourront.

Les larves percent alors un petit trou dans la peau de leur futur hôte, puis pénètrent et migrent dans son organisme, où elles deviennent des adultes capables de s’accoupler. Les femelles s’enchâssent alors dans les mâles, et commencent à pondre plusieurs centaines d’œufs par jour.
Excrétés en même temps que les matières fécales ou l’urine, ces œufs peuvent à leur tour se retrouver dans l’eau. Ils libèrent alors un second type de larve capable d’infecter les escargots d’eau douce : elles se multiplieront dans l’organisme de ces mollusques pour redonner des larves capables d’infecter des mammifères, perpétuant le cycle de vie du parasite.
Une maladie aux conséquences parfois lourdes
Les vers schistosomes se nourrissant des cellules sanguines de leur hôte, la bilharziose se traduit par une anémie et un retard de croissance. Elle produit en outre une inflammation de l’intestin, ainsi que de la vessie, avec présence de sang dans les urines.
Les conséquences les plus graves sont dues aux œufs qui ne parviennent pas à atteindre le monde extérieur. Ceux-ci demeurent piégés dans le foie où ils entraînent une inflammation chronique. Potentiellement, cette situation peut mener au développement d’un cancer hépatique.
En outre, chez les personnes malades, la pression dans la veine porte, la veine qui conduit le sang des intestins au foie, augmente de façon anormale, ce qui entraîne un risque d’hémorragie gastro-intestinale.
Des moyens de lutte limités
À l’heure actuelle, un médicament très efficace, appelé Praziquantel, est disponible pour lutter contre la bilharziose. Développé dans les années 1970 par la société pharmaceutique européenne Merck, qui le distribue gratuitement aux pays africains, il est utilisé dans le monde entier. Merck a également développé une forme adaptée aux enfants.
Mais cette molécule, considérée comme un médicament essentiel par l’Organisation mondiale de la Santé, est la seule qui se dresse entre l’être humain et les schistosomes. Malgré plus de 30 ans de recherche, les scientifiques ne sont pas encore parvenus à mettre au point d’autre médicament ni de vaccin.
L’une des craintes est qu’un jour, des résistances à cet unique médicament se développent. Cependant, pour l’instant, sur le terrain, aucune observation ne permet réellement d’affirmer que l’on s’acheminerait vers l’émergence de telles résistances. Une baisse d’efficacité a parfois été constatée, mais elle est très difficile à quantifier correctement en dehors des laboratoires.
L’autre problème est que le Praziquantel n’empêche pas la réinfection, et doit donc être administré régulièrement.
S’attaquer à l’escargot
Vous avez remarqué que le parasite a obligatoirement besoin d’un escargot pour accomplir son cycle de vie. Vous vous posez donc peut-être la question : ne pourrions-nous pas éliminer l’escargot ?
C’est en effet une possibilité, mais cette solution pose plusieurs problèmes : les produits chimiques qui tuent les escargots (appelés molluscicides) sont peu sélectifs et impactent de nombreux organismes aquatiques. Or, en réalité, très peu d’escargots sont infectés dans l’environnement. On éliminerait une énorme population d’escargots pour tuer ceux qui sont infectés. Ce n’est pas une approche très respectueuse de la nature !
Cette problématique des organismes « vecteurs » de maladies est commune à de nombreuses affections parasitaires. Les scientifiques ont commencé à réfléchir à une nouvelle approche, le « gene drive » ou « forçage génétique ».
Forcer des gènes délétères pour le parasite
Les prémisses de cette technique ont émergé dans les années 1960, après avoir constaté que certains gènes peuvent être transmis dans une population beaucoup plus rapidement que ce à quoi l’on s’attendrait d’après les lois de l’hérédité classiques (lois mendéliennes).
Chez les espèces qui se reproduisent sexuellement comme les vers schistosomes et les escargots d’eau douce, chaque gène existe en 2 copies : l’une héritée de la mère, l’autre du père. Lors de la reproduction sexuée, une seule de ces copies est transmise à la progéniture. Une copie a donc 50 % de chances d’être transmise.
[Plus de 85 000 lecteurs font confiance aux newsletters de The Conversation pour mieux comprendre les grands enjeux du monde. Abonnez-vous aujourd’hui]
Cependant, des copies « égoïstes » ont aussi évolué. Ces gènes parviennent à être hérités avec plus de 50 % de chance. Et parfois, beaucoup plus, car ils parviennent à éliminer les autres copies ! Tous ces processus sont naturels, mais imaginez un instant que nous puissions nous en inspirer et introduire un tel gène dans un parasite. Mieux : imaginez que ce gène soit nocif pour faire mourir les parasites… Nous tiendrions là une arme théoriquement très efficace.
C’est ce qu’ont réussi à faire des chercheurs de l’Imperial College de Londres en 2018 sur des moustiques transmettant le paludisme. Grâce à une puissante technique d’édition du génome, CRISPR-Cas9, ils ont modifié le gène déterminant leur sexe, afin de rendre les femelles stériles et de le forcer à se répandre dans une population de moustiques (en cage). Cette approche a mené à leur élimination en 7 à 11 générations, soit moins de 6 mois.
Forçage génétique et bilharziose
Jusqu’ici, cette technique n’était pas applicable sur les schistosomes, car CRISPR-Cas9 ne fonctionnait pas dans cet organisme. Mais depuis cette année, c’est le cas : nos laboratoires sont en effet parvenus à développer cette technique d’édition de gènes pour l’espèce Schistosoma mansoni_, qui cause la bilharziose intestinale.
Notre objectif n’était pas de rendre possible le forçage génétique, mais de disposer d’un outil pour inactiver des gènes à la demande, afin de comprendre les mécanismes à l’origine de la maladie et d’identifier de nouvelles cibles médicamenteuses ou d’autres moyens de lutte.
Néanmoins, cette technique CRISPR-Cas9 est maintenant disponible et pourrait ouvrir la voie au forçage génétique. À l’échéance de 5 à 10 ans, des études minutieuses, en laboratoire, pourraient aboutir à produire des parasites porteurs de gènes « suicide ». Libérés dans des régions où la maladie est endémique, ils pourraient éliminer les vers qui en sont à l’origine.
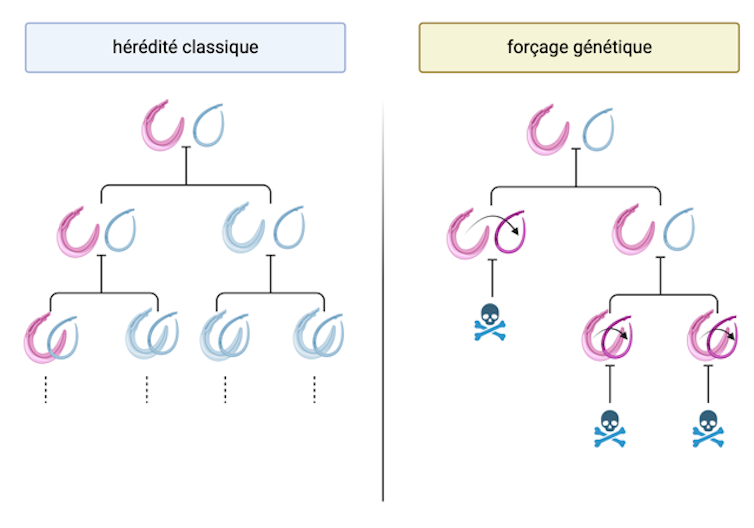
Si les avantages d’une telle approche vont de soi (éviter de donner des médicaments à vie ou de disséminer des substances molluscicides toxiques), y a-t-il des risques ?
Les limites du forçage génétique
Un problème potentiel est que le gène nocif pourrait se propager à d’autres espèces de schistosomes qui ne sont pas pathogènes pour l’être humain, par un processus appelé hybridation, qui se produit lorsque des espèces différentes s’accouplent. L’hybridation est en effet fréquente chez les schistosomes.
Une hybridation qui produit une progéniture fertile pourrait conduire à l’extinction d’espèces de schistosomes qui ne sont pas nocives pour les humains. En revanche, une hybridation qui ne donnerait pas de progéniture fertile représenterait une impasse pour le processus.
Aujourd’hui, on sait cependant quelles espèces de schistosomes sont capables de s’hybrider et de produire une descendance fertile. Des tests en laboratoire pourraient être menés afin de déterminer si le gène nocif introduit pourrait se propager à ces espèces.
Idéalement, une approche de forçage génétique devrait être dans un premier temps appliquée à une zone géographique très limitée, telle qu’une île entourée d’eau de mer (dans laquelle les schistosomes ne peuvent pas survivre).
Rendre possible le forçage génétique dans les schistosomes nécessitera encore des années de recherche, mais cette approche recèle un grand potentiel. Faut-il s’engager dans cette voie, ou y renoncer et se focaliser plutôt sur les alternatives ? Ne risquons-nous pas se nous retrouver sans ressource face à cet ennemi ?
Les réponses à ces questions, qui doivent faire l’objet d’un débat public éclairé, sont de plus en plus cruciales : l’augmentation des températures moyennes en Europe due au changement climatique permettra à un nombre croissant de parasites tropicaux de s’installer sur notre continent.
En attendant, si vous êtes allés récemment en Afrique ou dans le sud de la Corse et que vous constatez du sang dans vos urines (autrement dit, si elles deviennent rouges), parlez à votre médecin de la bilharziose, et demandez conseil à un parasitologue. Le traitement est simple et efficace. Et la prochaine fois, évitez ces eaux de baignade…

