Era telepon pintar baru berusia lebih dari satu dekade, tapi kehadian komputer berukuran saku yang telah mengubah kehidupan masyarakat ini dimungkinkan berkat adanya teknologi lain: baterai ion litium.
Baterai ion litium pertama kali dijual secara komersial pada 1991 oleh Sony untuk produk kamera videonya. Jenis baterai ini manfaatnya lebih dari sekadar sebagai alat elektronik portabel bagi konsumen.
Baterai ini merupakan wujud dari dua revolusi teknologi lainnya yang mampu mengubah masyarakat: transisi dari mesin pembakaran internal ke kendaraan listrik, dan pergeseran dari jaringan listrik berbahan bakar fosil ke generator energi terbarukan yang menyimpan kelebihan listrik dalam baterai untuk penggunaan pada masa depan.
Jadi bagaimana cara baterai ini bekerja? Para ilmuwan dan insinyur telah menghabiskan seluruh karier mereka untuk mencoba membangun baterai yang lebih baik dan hingga kini masih ada misteri yang tidak sepenuhnya kita pahami.
Meningkatkan kemampuan baterai membutuhkan keahlian ahli kimia dan fisikawan untuk melihat perubahan pada tingkat atomik, serta insinyur mekanik dan elektro yang dapat merancang dan merakit paket baterai yang memberi daya pada perangkat.
Sebagai seorang ilmuwan material di University of Washington dan Pacific Northwest National Lab di Amerika Serikat, saya telah membantu mengeksplorasi bahan baru untuk baterai lithium-udara, baterai magnesium, dan tentu saja baterai ion-litium.
Mari kita amati kehidupan dua elektron dalam satu hari dengan lebih dekat. Kami akan memberi nama salah satu dari mereka Alex dan ia memiliki teman bernama George.
Anatomi baterai
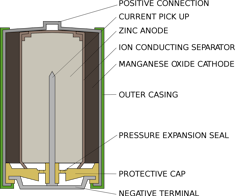
Alex hidup di dalam baterai AA alkali standar, seperti pada senter atau remote control Anda. Di dalam baterai AA, ada kompartemen yang diisi dengan seng dan yang lainnya diisi dengan oksida mangan. Di satu sisi, seng bergantung secara lemah pada elektron seperti Alex. Di sisi yang lain, mangan oksida secara kuat menarik elektron ke arah dirinya.
Di antara keduanya, untuk menghentikan elektron agar tidak berpindah langsung dari satu sisi ke sisi lain, terdapat selembar kertas yang direndam dalam larutan kalium dan air, yang hidup berdampingan sebagai ion kalium positif dan ion hidroksida negatif.
Ketika baterai dimasukkan ke dalam perangkat dan dihidupkan, sirkuit internal perangkat ini dijalankan. Alex ditarik keluar dari seng, melalui sirkuit dan masuk ke oksida mangan. Sepanjang jalan, gerakannya memberi daya pada perangkat, atau bola lampu atau apa pun yang terhubung ke baterai. Ketika Alex pergi, dia tidak bisa kembali: Seng yang telah kehilangan ikatan elektron dengan hidroksida membentuk seng oksida. Senyawa ini sangat stabil dan tidak mudah dikonversi kembali menjadi seng.
Di sisi lain baterai, oksida mangan memperoleh atom oksigen dari air dan meninggalkan ion hidroksida di belakang untuk menyeimbangkan hidroksida yang dikonsumsi oleh seng. Setelah semua tetangga Alex meninggalkan seng dan pindah ke oksida mangan, baterai itu habis dan perlu didaur ulang.
Keuntungan ion litium
Mari kita bandingkan dengan George, yang hidup dalam baterai ion litium. Baterai ion litium memiliki blok pembangun dasar yang sama dengan sel AA alkali, dengan beberapa perbedaan yang memberikan keuntungan besar.
George hidup dalam grafit, yang bahkan lebih lemah dari seng dalam memegang elektron. Dan bagian lain dari baterainya adalah lithium kobalt oksida, yang menarik elektron jauh lebih kuat daripada oksida mangan – yang memberi baterai kemampuan untuk menyimpan lebih banyak energi dalam jumlah ruang yang sama dibandingkan baterai alkalin. Larutan memisahkan grafit dan litium kobalt oksida mengandung ion litium bermuatan positif, yang dengan mudah membentuk dan memutus ikatan kimia ketika baterai habis dan diisi ulang.

Reaksi-reaksi kimia itu dapat terjadi dua arah, tidak seperti pembentukan seng oksida, yang membuat elektron dan ion lithium mengalir bolak-balik dalam banyak siklus pengisian dan pengosongan.
Namun proses ini tidak 100% efisien, semua baterai akhirnya kehilangan kemampuannya untuk menyimpan energi . Meski begitu, senyawa kimia Li-ion telah cukup kuat untuk mendominasi teknologi baterai saat ini.
Las Asimi Lumban Gaol menerjemahkan artikel ini dari bahasa Inggris.


