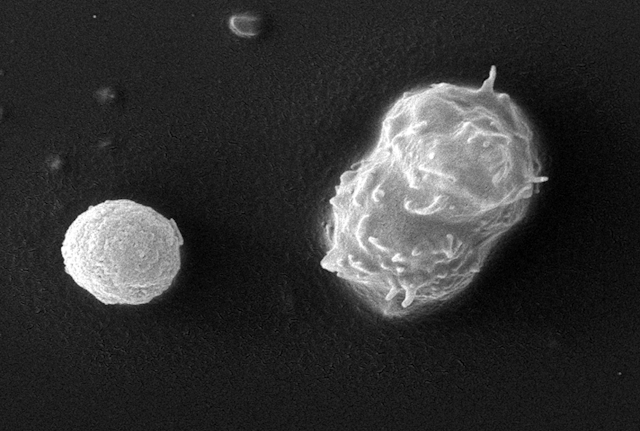
Lorsque leur environnement devient hostile, de nombreux microbes sont capables d’entrer dans une phase dormante, très résistante, y compris aux produits antimicrobiens. Appelée « kyste », cette forme leur permet d’attendre le retour de jours meilleurs. Cela pose un problème majeur lorsque les microorganismes concernés sont responsables de maladies, ou lorsqu’ils abritent en eux d’autres microbes potentiellement dangereux.
Pour parvenir à se débarrasser de ces microorganismes indésirables, il est essentiel de comprendre comment ils procèdent pour former de tels kystes, afin de les en empêcher ou de trouver des substances antimicrobiennes capables de détruire ces formes ultrarésistantes. Nous avons justement récemment réussi à décrypter comment l’amibe libre Acanthamoeba castellanii, responsable de graves encéphalites et d’infections oculaires, procède pour s’enkyster.
Nos travaux, publiés dans la revue Nature Communications, constituent un véritable atlas moléculaire des changements qui surviennent au cours de ce phénomène. Nous espérons qu’ils ouvriront des perspectives dans la recherche de nouvelles molécules anti-amibiennes destinées à mieux traiter les patients et à désinfecter plus efficacement les hôpitaux, les sites des industries agroalimentaires ou encore les eaux utilisées à des fins récréatives.
Les amibes libres, un problème de santé publique
Les amibes libres sont des êtres constitués d’une seule cellule appartenant au groupe des Protozoaires. On les trouve dans les sols, dans l’eau, et même parfois dans l’air. Certaines espèces sont dites amphizoïques, ce qui signifie qu’elles sont non seulement capables vivre de façon autonome dans l’environnement, mais aussi de parasiter certains êtres vivants, dont l’être humain. Dans ce dernier cas, elles peuvent être à l’origine de graves pathologies.
La plupart des touristes ont déjà entendu parler des diarrhées (amibiases) causées dans les pays chauds par l’amibe Entamoeba histolytica, qui contamine les eaux et certains aliments. Mais les amibes ne se rencontrent pas uniquement sous les tropiques. Dans les pays tempérés sévissent également des amibes pathogènes, telles que l’amibe Acanthamoeba castellanii, qui provoque de douloureuses inflammations de la cornée appelées kératites amibiennes. Bien que rare, cette maladie peut être sévère et menacer la vision en cas de lésions profondes. Difficile à traiter si le diagnostic est tardif, elle survient généralement chez les porteurs de lentilles de contact mal entretenues, mais elle peut aussi se déclarer après un traumatisme de la cornée ou un contact avec de l’eau contaminée.
Les Acanthamœba sont aussi responsables (tout comme l’amibe Balamuthia mandrillaris) d’encéphalites mortelles chez les patients immunodéprimés. Une autre espèce d’amibe, Naegleria fowleri, provoque quant à elle des méningo-encéphalites évoluant rapidement vers le coma et la mort.
Toutes ces amibes sont capables, comme de nombreux microorganismes, de se protéger très efficacement en se transformant en kystes, des formes dormantes très résistantes.
Quand les microbes se bunkérisent
Lorsque leur environnement devient hostile, certains microbes érigent des barrières imperméables faites de cellulose (molécule qui entre dans la composition des plantes) ou de chitine (molécule retrouvée dans la carapace des insectes ou des crustacés notamment) pour s’isoler. Certains organismes tels qu’Acanthamoeba synthétisent une paroi faite à la fois de cellulose et de chitine.
Sous cette forme appelée kystes (ou spores, si elle intervient dans la reproduction), leur activité métabolique est réduite, ce qui leur permet d’économiser leurs ressources et de survivre sur de longues périodes, en attendant que les conditions s’améliorent.
Isolés de l’environnement, les kystes formés par certaines amibes ne craignent ni le manque de nourriture, ni la dessication. Ils résistent également aux radiations ainsi qu’à de nombreux produits antimicrobiens. En laboratoire, des kystes d’Acanthamoeba sont restés vivants 24 ans à 4 °C !
Dès que les conditions redeviennent favorables, les kystes se retransforment en amibes actives, ce qui peut poser de sérieux problèmes de santé publique. On s’expose en effet à des résurgences d’infections par des microorganismes que l’on pensait avoir éliminés.
Par ailleurs, au-delà des maladies qu’elles provoquent directement, les amibes libres sont aussi des réservoirs de bactéries, dont certaines peuvent aussi causer des maladies.
Les amibes et leurs bactéries
Les amibes se nourrissent de bactéries qu’elles absorbent par phagocytose, autrement dit en les internalisant après les avoir « entourées ». Généralement, ces bactéries sont rapidement digérées, mais certaines d’entre elles, dites « résistantes aux amibes », peuvent survivre à ce processus. Certaines bactéries, telles que les légionelles, entrent dans l’amibe, consomment les éléments nutritifs qui s’y trouvent, se multiplient, puis induisent la destruction de leur hôte avant d’aller envahir d’autres cellules ou de vivre libres dans l’environnement.

Par ailleurs, il a été démontré que certaines bactéries deviennent plus virulentes et plus résistantes aux biocides et aux antibiotiques après leur passage dans les amibes.
Or, si l’amibe s’enkyste, ces bactéries bénéficient elles aussi de la protection conférée par cette forme très résiliente. Cette situation constitue donc un second argument pour lutter contre les formes kystiques.
Plutôt que d’essayer de tuer les kystes, une stratégie payante pourrait être d’empêcher la formation de la paroi, ce qui rendrait les amibes sensibles aux antimicrobiens. Il faut pour cela comprendre dans le détail comment les amibes procèdent pour s’empaqueter de la sorte. C’est précisément l’objet de nos travaux.
Re-étiquetage des protéines et modification de l’activité génétique
En condition de stress, par exemple lorsqu’elle manque de nourriture, les amibes libres commencent par modifier certaines de leurs protéines. Elles « retirent » en quelque sorte une « étiquette » chimique (en réalité, un groupe phosphate), ce qui va changer l’activité desdites protéines, qui vont alors induire l’expression de gènes pro-enkystement et réprimer les gènes anti-enkystement.
Pour comprendre l’enchaînement de ces processus, nous avons privé des amibes de nourriture afin de déclencher leur enkystement. Nous avons ensuite analysé les ARN qu’elles ont fabriqués au bout d’une heure, quatre heures et huit heures (produits à partir de l’information contenue dans les gènes, les ARN constituent en quelque sorte le « plan de montage » des protéines ; leur présence – ou absence – et leur quantité renseignent sur le niveau d’expression des gènes).
En parallèle, nous avons également examiné les modifications des « étiquettes » portées par les protéines des amibes. Celles-ci surviennent très rapidement, environ une heure après le début du « jeûne » forcé. Nos résultats indiquent que l’enkystement débute par une série de changements biochimiques qui touche de très nombreux gènes.
Parmi les conséquences notables de ces changements, les voies métaboliques impliquées dans la division cellulaire sont « mises en veille ». À l’inverse, l’activité de celles responsables de la fabrication des sucres augmente, ce qui s’explique probablement par la production de la paroi de cellulose du kyste (la cellulose étant un assemblage de sucres). Par ailleurs, durant l’enkystement, l’activité de dégradation des protéines s’accroît dans la cellule amibienne. En d’autres termes, la cellule « s’autodigère », et réutilise ses propres éléments pour se réorganiser.
Ces travaux, fruits d’une étroite collaboration entre notre laboratoire « Écologie et Biologie des Interactions », à Poitiers, et des collègues de l’Institut Pasteur de Paris, de l’Université de Vienne en Autriche et de l’Université de Copenhague au Danemark, ont permis de cartographier les changements qui, durant l’enkystement, affectent un très grand nombre d’ARN et de protéines amibiennes.
Ces résultats pourront être utilisés pour rechercher de nouvelles cibles anti-amibiennes efficaces contre les kystes. En outre, ils devraient vraisemblablement également aider à comprendre la chorégraphie moléculaire mise en jeu non seulement par les amibes Acanthamœba, mais aussi par d’autres espèces, ainsi que par d’autres protozoaires capables de s’enkyster, tels que les agents responsables de la toxoplasmose.