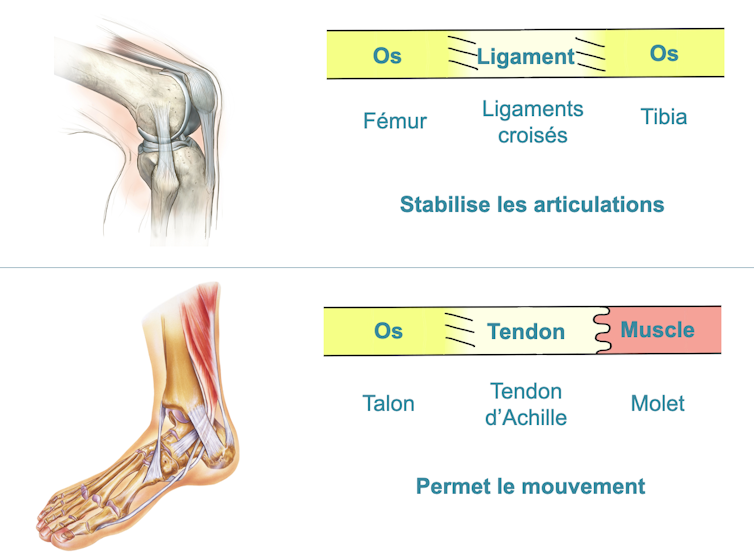
C’est notamment grâce à nos 500 tendons que nous sommes capables de bouger, car ils font le lien entre nos os et nos muscles. Mais comme le célèbre talon d’Achille, ils sont aussi un de nos points faibles : ils peuvent se rompre, et leur cicatrisation est alors très compliquée – tout comme les ligaments, qui font quant à eux le lien entre deux os.
Un gros enjeu pour certains sportifs – environ 40 % des joueurs de tennis sont touchés par des inflammations du tendon du coude, et cela peut doubler chez les joueurs de plus de 40 ans. Une rupture de tendon peut aussi être synonyme de fin de carrière, comme ce fut le cas de Yoann Huget, qui a dû arrêter sa carrière de rugbyman en 2021 après une rupture du tendon d’Achille.
Et cela ne se limite pas aux athlètes ! En effet, les personnes âgées sont aussi atteintes par des ruptures du tendon car avec l’âge ces derniers deviennent plus fragiles et ne se régénèrent plus aussi vite qu’ils se dégradent. Environ 30 % des consultations pour des troubles musculo-squelettiques sont liées à des tendinopathies. Ainsi, avec le vieillissement global de la population, comprendre comment réparer les tendons devient un enjeu majeur de santé publique.
Faire pousser des tissus artificiels pour remplacer les tendons rompus
Grâce aux progrès en ingénierie tissulaire et à l’utilisation de biomatériaux, on développe de nouvelles approches pour tenter de réparer les ruptures des tendons. L’idée est de cultiver des cellules dans des conditions particulières sur une « matrice » artificielle (appelée scaffold en anglais), qui leur sert de support, un peu comme un échafaudage pour construire une maison. L’objectif est que cet ensemble développe les caractéristiques biologiques et mécaniques d’un tissu humain « naturel ».
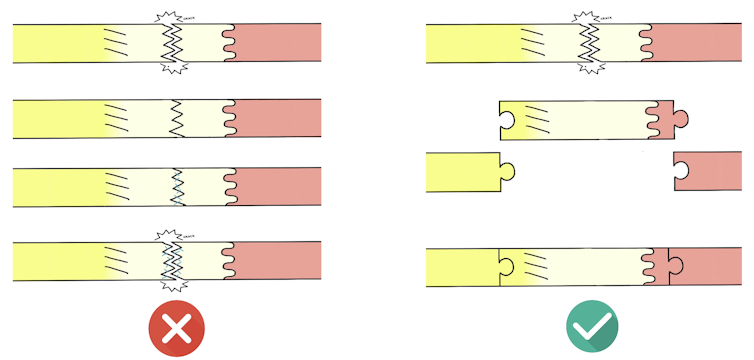
Cependant, recréer un tendon neuf ne suffit pas, encore faut-il pouvoir l’implanter efficacement. En effet, comme le tendon se régénère très mal, suturer un substitut sur un tissu dégradé ou rompu n’est pas une solution viable : du fait d’une faible vascularisation locale, il reçoit moins de signaux favorisant la cicatrisation et la réparation… et risque de rompre à la première sollicitation mécanique.
C’est pourquoi, dans le laboratoire CNRS Biomécanique et Bioingénierie BMBI à l’Université de Technologie de Compiègne, nous proposons d’élargir le champ de vision en associant les deux « voisins » du tendon : l’os et le muscle.
En effet, l’os a une capacité d’autorégénération qui s’appuie sur des mécanismes de renouvellement cellulaire, ce qui explique que les fractures osseuses se réparent naturellement. Pour les muscles, la régénération passe par les cellules souches myogéniques.
L’idée est donc de fabriquer en laboratoire un tendon avec, à une extrémité, une composante osseuse, et à l’autre, une composante musculaire. Ceci devrait permettre in fine de greffer le continuum os-tendon-muscle artificiel à l’os et au muscle du patient – une greffe qui devrait mieux tenir que les greffes de tendons artificiels sur tendons endommagés.
Comment orienter le devenir des cellules souches
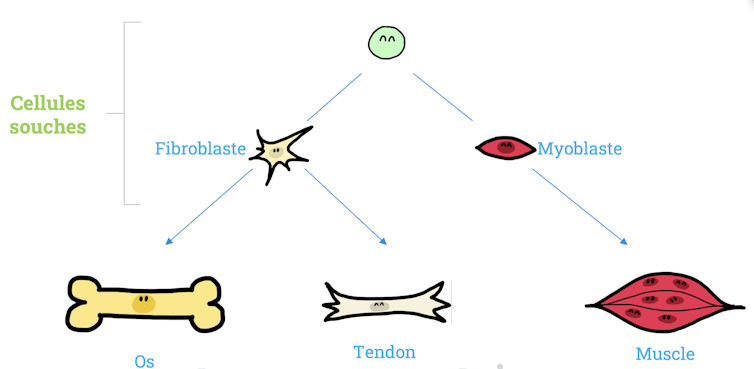
Les cellules souches sont initialement pluripotentes, c’est-à-dire qu’elles peuvent encore devenir différents types de cellules. Cette différenciation se fait naturellement in vivo jusqu’à atteindre un type de cellule spécialisée et fonctionnelle dans chaque tissu.
Mais il est également possible de guider in vitro la différenciation vers des cellules osseuses (ostéoblastes), tendineuses (ténocytes) ou musculaires (myotubes), en jouant sur leur environnement, par exemple des facteurs chimiques, des stimulations physiques ou le matériau servant de support.
C’est une combinaison de ces deux dernières approches que nous avons choisie : en travaillant sur les propriétés du « scaffold » (composition, architecture, propriétés mécaniques…) et en exerçant un étirement cyclique, nous avons démontré que l’on peut amorcer la différenciation des cellules souches vers les différents phénotypes d’intérêt (os, tendon ou muscle).
Le scaffold est fabriqué à partir d’un polymère biocompatible (le polycaprolactone) mis sous forme de nanofils. On obtient ainsi des supports de quelques dizaines de microns d’épaisseur, plus ou moins poreux, et dont la topographie dépend du collecteur qui réceptionne les fibres extrudées.
Par exemple, sur des fibres disposées aléatoirement, les cellules souches ont tendance à évoluer vers un phénotype tendineux (tendon) si on leur impose des cycles d’étirement.
Sur des fibres structurées en forme de nids d’abeille, les cellules deviennent plus aisément de l’os. Enfin, sur des fibres bien alignées, elles fusionnent en myotubes longs et bien droits, comme on en trouve dans le tissu musculaire.

Nous sommes parvenus à fabriquer d’un seul tenant ce matériau composé de ces différentes structures – nids d’abeille, aléatoire et alignée – pour ensuite cultiver des cellules souches qui deviennent de cellules osseuses, tendineuses ou musculaires suivant leur localisation.
À ce stade, ce sont plutôt des approches innovantes en microfabrication qui sont mobilisées, comme le « gap-spinning », une variante de la technique utilisée pour fabriquer les nanofils, ou encore la fabrication de collecteurs spécifiques par impression 3D ou photolithographie.
Dans un premier temps, on n’envisage pas d’aboutir à une solution implantable chez les patients, mais de proposer un modèle d’étude in vitro des jonctions os-tendon et tendon-muscle, afin de mieux comprendre la formation et la dégradation de ces jonctions, notamment en termes de vieillissement et de réponse aux chocs. Ainsi, nous pourrons évaluer différentes stratégies thérapeutiques pour traiter les pathologies des personnes âgées et des sportifs, sans recourir à l’expérimentation animale.

Cet article est publié dans le cadre de la Fête de la science (qui a lieu du 6 au 16 octobre 2023 en métropole et du 10 au 27 novembre 2023 en outre-mer et à l’international), et dont The Conversation France est partenaire. Cette nouvelle édition porte sur la thématique « sport et science ». Retrouvez tous les événements de votre région sur le site Fetedelascience.fr.

