La communauté scientifique est préoccupée par la perspective d’utiliser les manipulations génétiques pour créer des humains « à la carte », modifiés sur demande.
La modification dirigée du génome pourrait vraisemblablement avoir des conséquences sur l’humanité plus graves que les changements climatiques et le péril de l’énergie atomique.
Pourtant, là n'était pas l'intention à l'origine de cette découverte.
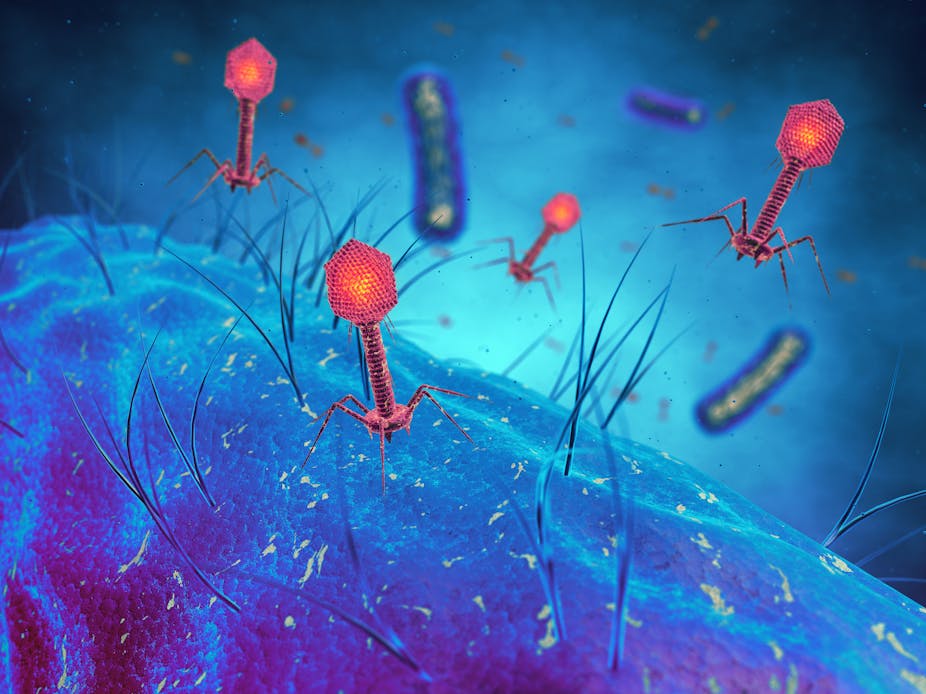
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), la technique révolutionnaire qui permet de modifier le génome à volonté, est issue d’un mécanisme utilisée par les bactéries comme moyen de défense contre les infections par des bactériophages – la forme de vie la plus abondante sur Terre.
Plus petite que toute forme de vie connue
Les bactériophages ont été découverts par Félix d’Hérelle en 1917 à l’Institut Pasteur de Paris. Il étudiait alors une cohorte de patients guérissant spontanément de la dysenterie. D’Hérelle a proposé que les bactéries causant la dysenterie chez ces patients étaient tuées par un « anti-microbe », plus petit que toutes formes de vie connue. Il a démontré de façon concluante l’existence de ce nouvel organisme qu’il a nommé bactériophage (virus qui infecte les bactéries).

Les bactériophages ont été étudiés en détail. Leur esthétisme a été mis en évidence par la microscopie électronique, alors que leur génome a été le premier à être séquencé.
Répondre à une attaque de bactériophage
En 2007, Rodolphe Barrangou et Philippe Horvath de la compagnie de production alimentaire Danisco ont collaboré avec Sylvain Moineau, de l’Université Laval, pour résoudre un problème de longue date qui minait la production du yogourt. Ils se sont demandés pourquoi les bactéries utilisées à la production du yogourt et du fromage étaient la cible d’attaques par des bactériophages et comment les prévenir.
Barrangou, Horvath et Moineau ont alors fait la découverte stupéfiante que les bactéries avaient un système immunitaire.
A la suite d’une infection par des bactériophages, un petit nombre de bactéries survivantes étaient en mesure de reconnaître l’ADN de ces organismes lors d’une attaque subséquente. Leurs observations ont mis en évidence que les bactéries qui survivaient à l’attaque initiale intégraient dans leur génome un fragment de l’ADN des bactériophages leur servant de mémoire de l’infection.
Cibler et couper
Barrangou, Horvath et Moineau ont ensuite découvert comment les bactériophages sont éliminés. Lors de reconnaissance, la bactérie ciblerait et trancherait l'ADN du bactériophage nouvellement envahissant. Ainsi, les bactéries pouvaient élaborer une réponse immunitaire menant à la destruction des bactériophages.
Les biologistes Jennifer Doudna et Emmanuelle Charpentier ont découvert par la suite les « guides » utilisés par les bactéries pour élaborer leur mécanisme de défense. Ainsi, un bactériophage dont l’ADN correspond aux « fragments mémoires » acquis par les bactéries lors d’une première infection est reconnu. Les « guides » découvertes par Doudna et Charpentier ciblent une enzyme coupeuse nommée Cas9 qui trancherait l’ADN des bactériophages envahissants. Cette machinerie est connue sous le nom de CRISPR-Cas9.
L’utilisation commerciale de cette découverte n’allait pas tarder. Doudna, Charpentier et d’autres chercheurs ont reconnu rapidement que ce nouveau système biologique pourrait être utilisé pour manipuler les gènes de toutes formes de vie.
CRISPR-Cas9 n’est pas le premier système permettant de modifier les gènes à être découvert. En 1993, le regretté biochimiste Michael Smith, alors à l’Université de Colombie-Britannique, a obtenu le prix Nobel de chimie pour la découverte d’un système chimique d’édition des gènes, la mutagénèse dirigée, pouvant servir à la lutte contre le cancer et d’autres maladies.
Les bactériophages comme solution potentielle
D’Hérelle a observé que les bactériophages isolés d’un patient ayant guéri de la dysenterie pouvaient être utilisés pour protéger des lapins de cette infection fatale. Avant la découverte des antibiotiques, la découverte de d’Hérelle a inspiré Sinclair Lewis à faire des bactériophages un outil thérapeutique humain dans son roman Arrowsmith, récompensé d’un prix Pulitzer.
L’une des plus grandes collections de bactériophages nommée en l’honneur de Félix d’Hérelle est à l’Université Laval à Québec. Sylvain Moineau en est le curateur.
Il est à souhaité que les bactériophages puissent être utilisés comme moyen thérapeutique pour contrer la résistance aux antibiotiques. Toutefois, cet espoir est amoindri par l’utilisation actuelle controversée du système CRISPR-Cas9 et son exploitation commerciale.
Dans ce contexte, les conséquences d’ouvrir une boîte de Pandore nous guettent. L’utilisation du système CRISPR-Cas9 pour créer des humains « à la carte » en manipulant les gènes des cellules germinales résulterait en des changements permanents passés de génération en génération. Il est à craindre que l’effet de telles manipulations soit comparable aux conséquences d’une guerre nucléaire ou des changements climatiques.
Mais il existe d'autres applications potentielles de CRISPR-Cas9 « non germinatif ». Cela a récemment été accompli avec succès pour un modèle de la dystrophie musculaire. Comme le mythe de la boîte de Pandore, le pessimisme suscité par l’édition de gènes « en lignée germinale » peut être compensé par l’espoir de bénéfices futurs pour l’humanité.
John Bergeron remercie Kathleen Dickson en tant que co-auteure et Michel Desjardins (l’Université de Montréal) pour ses idées, corrections et modifications.